Belangrijke grondstof vaak onderbelicht
Er wordt heel wat gesproken en geschreven over grondstoffen voor de ambachtelijke ijsbereiding. De meest belangrijke grondstof blijft echter meestal onderbelicht: water. Geen ijs zonder water. Sterker nog, water is het ingrediënt dat het grootste aandeel heeft in de receptuur. In roomijs gemiddeld zo’n 65% en in sorbetijs zelfs nog meer.
Water is water zou je zeggen. Toch is dit afhankelijk van de plaats waar het drinkwater wordt gewonnen. Het verschil is misschien klein, maar het heeft invloed op de smaak en dus ook op de smaak van het product waarin het water verwerkt wordt.
Behalve smaak heeft water nog een aantal belangrijke functies bij het bereiden en consumeren van ijs:
- Water dient als oplosmiddel tijden de mixbereiding.
- Water vormt ijskristallen tijden de ijsbereiding.
- Bevroren water dient als koudemiddel bij het consumeren.
- Gesmolten water dient als transportmiddel in de mond bij het inslikken.
Water als oplosmiddel
Bij de bereiding van ijsmix dient water als oplosmiddel voor de oplosbare ingrediënten uit de receptuur. Hierbij moet je bijvoorbeeld denken aan suikers, oplosbare eiwitten en zouten. Tijdens het oplossen vallen de oplosbare stoffen in moleculen (de kleinste deeltjes van een stof die nog de eigenschappen van de stof bevatten) uiteen in het oplosmiddel. Bij een ijsmix zijn dat bijvoorbeeld de suikers. De moleculen van het oplosmiddel, in dit geval de watermoleculen, bewegen zich dicht om de suikermoleculen heen, waardoor ze uit elkaar worden gedreven. Zo ontstaat een oplossing. Als er veel suiker wordt toegevoegd, zijn er veel watermoleculen nodig om de suikermoleculen van elkaar te houden. De viscositeit ofwel taaivloeibaarheid van de oplossing neemt hierdoor toe. Als we alleen suiker in water oplossen, ontstaat op deze manier een suikerstroop.
Het verschilt per stof of de moleculen makkelijk of moeilijk uit elkaar te drijven zijn door de watermoleculen. Sacharose (gewone tafelsuiker) bijvoorbeeld lost makkelijk op, terwijl lactose (melksuiker) veel moeilijker oplost. Er zijn meer watermoleculen nodig om lactosemoleculen uit elkaar te drijven. Met andere woorden: je kunt minder lactose dan sacharose oplossen in eenzelfde hoeveelheid water.
De meeste stoffen lossen sneller op wanneer de temperatuur van het mengsel wordt verhoogd. Bij warme ijsmixbereiding lossen de oplosbare grondstoffen dan ook sneller op en vormen een homogener mengsel dan bij de koude mixbereiding.
Het vormen van ijskristallen
Moleculen zijn beweeglijk. Bij vaste stoffen is de beweging minimaal en zijn ze vaak netjes geordend, zodat er een vaste vorm ontstaat. Bij vloeibare stoffen rollen de moleculen over elkaar heen en is de massa vormloos. Neem nu water. Zolang het vloeibaar is, rollen de watermoleculen over elkaar en kan het product alle kanten opvloeien. Wordt de temperatuur verhoogd, dan gaan de moleculen steeds meer bewegen, waardoor ze ook steeds meer ruimte innemen. Op een bepaald moment wordt de beweeglijkheid zo groot dat de moleculen zich losmaken uit de vloeistof en overgaan in waterdamp: het water kookt. Als de temperatuur daalt, wordt de beweeglijkheid minder, net zolang totdat ze stil staan. De moleculen kruipen dan tegen elkaar aan en vormen een zogenaamd kristalrooster: het water bevriest.
Zuiver water bevriest bij 0°C en vormt een heel hecht kristalrooster, wat resulteert in heel hard ijs. Zo hard, dat we er in de winter op kunnen schaatsen. Wanneer er in het water andere stoffen zijn opgelost, verstoort dat het vormen van een kristalrooster. De watermoleculen die nodig zijn om de opgeloste stof in oplossing te houden, kunnen hiervan moeilijk loskomen en doen niet mee aan het vormen van een kristalrooster. Dit lukt wel als we de temperatuur verder laten dalen. Dit noemen we vriespuntverlaging. Water waarin 10% suiker is opgelost, zal niet bij 0°C bevriezen maar bij ongeveer -2,5°C. Het ijs wordt niet alleen bij een lagere temperatuur gevormd, maar ook de samenhang wordt minder doordat er tussen de ijskristallen nog opgeloste suikermoleculen zitten met vloeibare watermoleculen daar omheen. Het ijs wordt hierdoor minder hard. Afhankelijk van de hoeveelheid opgeloste stof en de molecuulgrootte van de stof die in het water is opgelost, moet er meer of minder ver gekoeld worden om een bepaalde stevigheid te krijgen. Dat is de reden waarom dextrose bij eenzelfde hoeveelheid bijna tweemaal zoveel vriespuntverlaging geeft als sacharose. Dextrose moleculen zijn tweemaal zo klein als sacharose moleculen. Grote moleculen zoals in glucosepoeders met een lage DE waarde voorkomen, geven minder vriespuntverlaging.
Wat betekent dat voor ambachtelijk schepijs
Zoals iedere ambachtelijke ijsbereider weet, bestaat een ijsmixrecept voor 60% tot 70% uit water. Dat water is niet altijd zuiver leidingwater. Het zit meestal verstopt in de ingrediënten die we voor de mix gebruiken. Volle verse melk bevat bijvoorbeeld 88% water en de rest is melkvet, melksuiker, melkeiwit en een beetje mineralen en zouten. De oplosbare componenten (melksuiker en oplosbare eiwitten) zijn in het water opgelost en de onoplosbare componenten (melkvet en onoplosbare eiwitten) zijn er heel fijn in verdeeld. Slagroom bevat veel minder water en veel meer vet. Ook hier zijn de oplosbare componenten in het water opgelost en de onoplosbare deeltjes heel fijn in de room verdeeld. Bij melkpoeders is dat anders. Melkpoeder bevat hooguit enkele procenten water. De rest is droge stof, die zowel oplosbare delen bevat (lactose en oplosbare eiwitten) als onoplosbare delen (melkvet en onoplosbaar eiwit). Er is te weinig water aanwezig om de oplosbare componenten in op te lossen. Bij gebruik van melkpoeder moeten we tijdens de mixbereiding de juiste hoeveelheid water toevoegen om de oplosbare stoffen goed te kunnen laten oplossen.
Met de wetenschap dat de vorming van ijskristallen wordt beïnvloed door de hoeveelheid opgeloste stoffen in de ijsmix, kunnen we het volgende zeggen over een goed ambachtelijk schepijs:
- Het percentage water in een ijsmix ligt tussen de 60% en 70%.
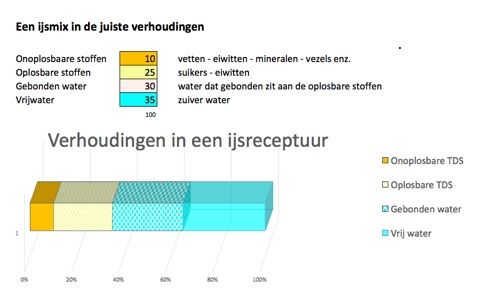
- In ijs met de juiste schepeigenschappen zal ongeveer 50% van het water omgezet zijn in ijskristallen. (Zie afbeelding 1)
Verhoudingen in de receptuur
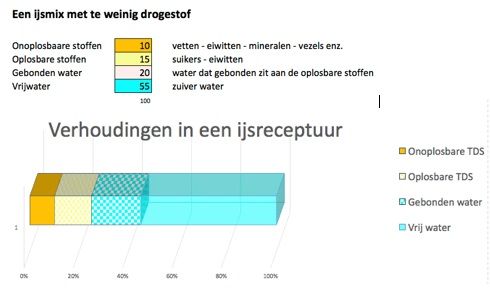
Als de verhouding van water en drogestof uit balans is, is dat direct merkbaar aan het ijs. Bij te weinig droge stof is er dus veel water aanwezig, dat bij het afdraaien van het ijs wordt omgezet in ijskristallen. Hierdoor wordt het ijs hard en te koud. (Zie afbeelding 2)
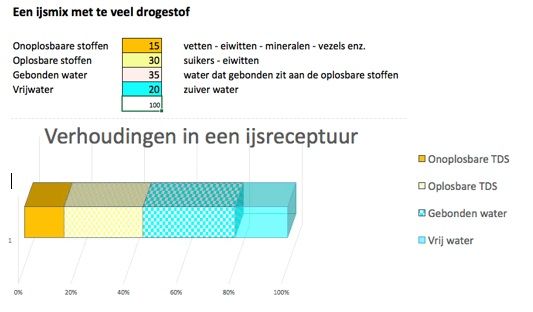
Bij teveel droge stof is het precies andersom. Het hangt er wel vanaf wat de samenstelling van de droge stof is. Zijn het vooral oplosbare stoffen, dan zijn er veel watermoleculen nodig om de stoffen in oplossing te houden en is er weinig water beschikbaar om ijskristallen te vormen. Het ijs zal dan minder hard zijn en minder koud in de mond aanvoelen. (Zie afbeelding 3) Bestaat de droge stof voor een belangrijk deel onoplosbare delen, bijv. vet, dan wordt het ijs juist hard.
De koubeleving in de mond
IJs is koud: dat weet iedereen. Maar hoe komt dat en hoe kun je verklaren dat de ene ijssmaak kouder aanvoelt dan de andere? Het antwoord ligt in de aantallen ijskristallen die je per hapje ijs in je mond neemt. Om ijskristallen te laten smelten, is energie nodig. Als ijskristallen in je mond smelten, wordt de energie die daarvoor nodig is in de vorm van warmte onttrokken aan je mond. Dit ervaar je als een koud gevoel. Koelt je mond teveel af, dan wordt de smaakbeleving ook veel minder. Het is dus belangrijk om te weten hoe de water/ijsverhouding in het ijs is.
Om één gram water of ijs 1°C in temperatuur te laten stijgen of dalen, kost dat aan energie 4,18 joule. Een joule is een natuurkundige eenheid voor energie. Om één gram water te transformeren naar ijs of ijskristallen te laten smelten naar water kost 334,4 joule per gram. Dat is dus tachtig keer zoveel als water of ijs 1°C in temperatuur te laten stijgen of dalen.
Om die reden voelt een ijsklontje van -1°C in de mond veel kouder aan dan een hapje ijs van -15°C. Het ijsklontje bestaat uit alleen maar ijskristallen en het zijn er veel meer dan in het hapje schepijs, dat voor ongeveer 65% uit water bestaat en waarvan de helft maar bevroren is. Er zijn dus veel minder ijskristallen aanwezig en deze onttrekken bij het afsmelten dan ook veel minder warmte aan je mond, waardoor dit minder koud aanvoelt.
Water als transportmiddel
Behalve de temperatuur in je mond, is ook de afsmeltsnelheid bij het eten van ijs een belangrijk gegeven om de gewenste smaakbeleving te ervaren. Bij het afsmelten van ijs komt de smaak vrij. De afsmeltsnelheid bepaalt de tijd dat een hapje ijs in je mond blijft en je de smaak beleeft. Hoe snel het ijs smelt, wordt onder andere bepaald door de hoeveelheid lucht in het ijs en de stabilisatie van het bindmiddel.
Tijdens het afdraaien van het ijs worden veel luchtbelletjes ingedraaid, gemiddeld zo’n 30% tot 40%. Bij het eten van ijs vertragen deze luchtbelletjes de warmtetransport, waardoor het minder snel afsmelt en minder koud aanvoelt. Bindmiddel vertraagt de afsmeltsnelheid doordat de vloei-eigenschappen van het water worden vertraagd.
Als het ijs te snel afsmelt, komt er snel veel water vrij en daalt de temperatuur in de mond ook snel. Door de lage temperatuur beleef je de smaak minder, die dan ook nog verder wordt verdund door de hoeveelheid water die vrijkomt. Het waterige gesmolten goedje spoelt dan snel weg, waardoor je niet de gewenste beleving ervaart. Wanneer ijs te langzaam afsmelt, is het tegenovergestelde aan de hand. Te weinig smeltwater veroorzaakt dat het ijs niet gemakkelijk wordt doorgeslikt en te lang in je mond achterblijft ontstaat een negatief smaakeffect. De juiste afsmeltsnelheid en de viscositeit van het gesmolten ijs zijn dus van essentieel belang om de volledige smaakervaring te beleven.
Conclusie
Water is water. Zo begon ik dit artikel. Ik hoop dat u zich er na het lezen van deze tekst bewust van bent geworden, dat water - op de ingeslagen lucht na - niet alleen de goedkoopste grondstof is in ijs, maar ook een van de belangrijkste.

Jacques Vos
- Voorzitter Ambachtelijk IJscentrum